Nature Cell Biology | 我院曹中炜/丁楅森团队发现肿瘤血管驱动Angiocrine介导的耐药机制
2025-09-08 16:11:31科技部
化疗耐药是导致癌症治疗失败和患者死亡的主要原因。传统观点聚焦于肿瘤细胞自身的基因突变和修复机制。然而,越来越多的研究发现,单纯关注肿瘤细胞并不能完全解释耐药的复杂性。肿瘤微环境不仅为肿瘤提供营养和结构支持,还会在化疗应激下发生重塑,从而营造出有利于肿瘤生存的环境。但肿瘤微环境,尤其是肿瘤血管如何响应化疗并驱动耐药,其具体机制仍未明晰。
我院曹中炜和丁楅森团队长期致力于探索血液和血管内皮细胞作为引导性微环境的主动调控作用,并揭示了病变组织中的血管在慢性损伤中,通过释放旁分泌(Angiocrine)因子导致器官纤维化并刺激肿瘤进展1-12。9月5日,团队联合妇科郑艾,病理科王巍在Nature Cell Biology杂志上发表题为 “MLKL PARylation in the endothelial niche triggers angiocrine necroptosis to evade cancer immunosurveillance and chemotherapy” 的研究论文。该研究通过整合临床患者样本、多组学分析与小鼠模型,揭示了一种全新的化疗耐药机制:化疗药物激活肿瘤内皮细胞中的PARP1,并通过PARylation修饰坏死性凋亡关键蛋白MLKL,诱导内皮细胞发生坏死性凋亡,进而释放大量趋化因子SDF1;SDF1以“血管分泌(angiocrine)”方式抑制肿瘤相关巨噬细胞(TAMs)产生抗肿瘤因子CXCL10,进而阻碍细胞毒性CD8+ T细胞的浸润和效应功能,导致卵巢癌和乳腺癌的免疫逃逸和化疗耐药。
研究人员通过分析卵巢癌和乳腺癌患者样本发现,化疗处理后,肿瘤内皮细胞而非肿瘤细胞内PARP1的活性显著升高,且与患者的不良预后呈正相关,而这归因于内皮细胞对化疗诱导的DNA损伤更为敏感。通过蛋白质组学筛选,团队鉴定出MLKL(混合谱系激酶结构域样蛋白)是PARP1在内皮细胞中的关键修饰底物。进一步分析表明,MLKL在T253和E351位点发生RARylation修饰,促使其构象改变和寡聚化,从而触发坏死性凋亡。
结合单细胞多组学和基因工程小鼠模型,研究人员发现化疗后肿瘤血管出现一个SDF1+内皮细胞亚群,该亚群高表达坏死性凋亡相关标志物。与此同时,肿瘤微环境中具有抗肿瘤潜能的巨噬细胞亚群CXCL10+ TAMs显著较少。该巨噬细胞亚群高表达CXCL10、CXCL11和CCL8,能够协同增强免疫应答。机制研究显示,坏死性凋亡的内皮细胞会释放大量的SDF1,通过激活免疫细胞表面CXCR4受体,抑制了CXCL10+巨噬细胞的功能。进一步分析发现,CXCL10的受体CXCR3主要表达于CD8+ T细胞,而化疗后肿瘤内具有高细胞毒性的CXCR3+CD8+效应T细胞显著较少。这一免疫抑制作用依赖于内皮PARP1-SDF1信号轴的激活。值得注意的是,特异性敲除内皮细胞中的PARP1、MLKL或SDF1,均能恢复CXCL10+ TAMs和CXCR3+CD8+ T细胞的抗肿瘤功能,显著提高化疗效果。
在进一步建立的多周期化疗小鼠卵巢癌耐药模型中(模拟临床反复化疗后耐药的发生过程),研究人员发现随着化疗周期的增加,野生型小鼠肿瘤逐渐对化疗药物产生耐药,伴随肿瘤内皮细胞中SDF1的表达持续升高,CXCL10+ TAMs和CXCR3+CD8+ T细胞逐渐减少。而内皮细胞特异性敲除Parp1或Mlkl可显著延缓这种耐药性的发展,维持肿瘤对化疗的敏感性。
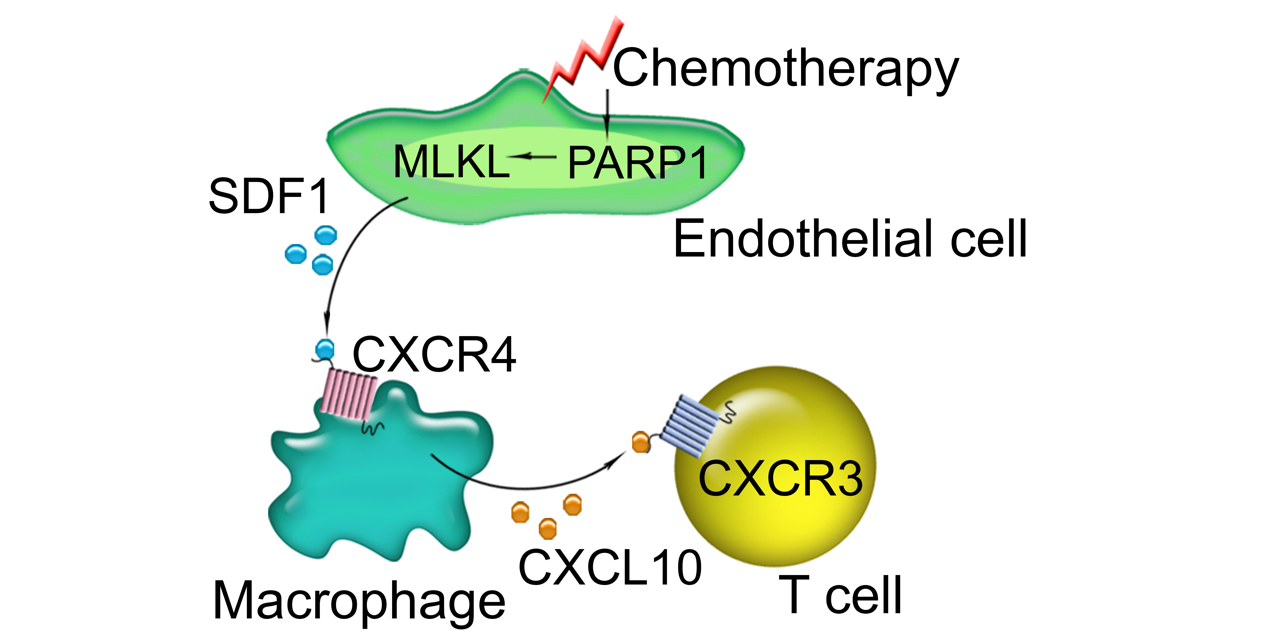
该研究揭示了肿瘤血管内皮细胞在化疗过程中通过PARP1介导的MLKL PARylation发生坏死性凋亡,从而驱动SDF1分泌,重塑免疫异质性微环境并促进肿瘤化疗耐药。所提出的PARP1-MLKL-SDF1信号轴不仅拓展了对耐药机制的理解,也为开发靶向血管微环境、联合PARP抑制剂与免疫治疗的新型抗肿瘤策略提供了潜在靶点。
四川大学杨柟、李小雪、黄雯雯、姬改利、罗威、姜法明为论文的共同第一作者,通讯作者为我院曹中炜、丁楅森、郑艾、王巍教授。曹中炜与丁楅森课题组基于四川大学华西第二医院长期研究器官修复和肿瘤中的血管微环境,开发基于Angiocrine功能的药物,并开展临床实验。团队诚招上游靶点研究,药物开发,人群临床研究及药物临床实验,化学生物学,生物信息及多组学等学科的研究员,副研究员,博士后及实验人员,并热烈欢迎感兴趣的研究生及本科生加入。
原文链接:https://www.nature.com/articles/s41556-025-01740-8
DOI:10.1038/s41556-025-01740-8
参考文献:
1. Mo C, Li H, Yan M, Xu S, Wu J, Li J, Yang X, Li Y, Yang J, Su X, Liu J, Wu C, Wang Y, Dong H, Chen L, Dai L, Zhang M, Pu Q, Yang L, Ye T, Cao Z, Ding BS. Dopaminylation of endothelial TPI1 suppresses ferroptotic angiocrine signals to promote lung regeneration over fibrosis. Cell Metab. 2024 Aug 6;36(8):1839-1857.e12. doi: 10.1016/j.cmet.2024.07.008.
2. Ma J, Zhang L, Zhang X, Zhang L, Zhang H, Zhu Y, Huang X, Zhang T, Tang X, Wang Y, Chen L, Pu Q, Yang L, Cao Z, Ding BS. Inhibiting endothelial Rhoj blocks profibrotic vascular intussusception and angiocrine factors to sustain lung regeneration. Sci Transl Med. 2024 Aug 28;16(762):eado5266. doi: 10.1126/scitranslmed.ado5266.
3. Qing J, Ren Y, Zhang Y, Yan M, Zhang H, Wu D, Ma Y, Chen Y, Huang X, Wu Q, Mazhar M, Wang L, Liu J, Ding BS, Cao Z. Dopamine receptor D2 antagonism normalizes profibrotic macrophage-endothelial crosstalk in non-alcoholic steatohepatitis. J Hepatol. 2022 Feb;76(2):394-406. doi: 10.1016/j.jhep.2021.09.032.
4. Chen Y, Pu Q, Ma Y, Zhang H, Ye T, Zhao C, Huang X, Ren Y, Qiao L, Liu HM, Esmon CT, Ding BS, Cao Z. Aging Reprograms the Hematopoietic-Vascular Niche to Impede Regeneration and Promote Fibrosis. Cell Metab. 2021 Feb 2;33(2):395-410.e4. doi: 10.1016/j.cmet.2020.11.019.
5. Zhang H, Ma Y, Cheng X, Wu D, Huang X, Chen B, Ren Y, Jiang W, Tang X, Bai T, Chen Y, Zhao Y, Zhang C, Xiao X, Liu J, Deng Y, Ye T, Chen L, Liu HM, Friedman SL, Chen L, Ding BS, Cao Z. Targeting epigenetically maladapted vascular niche alleviates liver fibrosis in nonalcoholic steatohepatitis. Sci Transl Med. 2021 Oct 6;13(614):eabd1206. doi: 10.1126/scitranslmed.abd1206.
6. Ding BS, Yang D, Swendeman SL, Christoffersen C, Nielsen LB, Friedman SL, Powell CA, Hla T, Cao Z. Aging Suppresses Sphingosine-1-Phosphate Chaperone ApoM in Circulation Resulting in Maladaptive Organ Repair. Dev Cell. 2020 Jun 22;53(6):677-690.e4. doi: 10.1016/j.devcel.2020.05.024.
7. Cao Z, Ye T, Sun Y, Ji G, Shido K, Chen Y, Luo L, Na F, Li X, Huang Z, Ko JL, Mittal V, Qiao L, Chen C, Martinez FJ, Rafii S, Ding BS. Targeting the vascular and perivascular niches as a regenerative therapy for lung and liver fibrosis. Sci Transl Med. 2017 Aug 30;9(405):eaai8710. doi: 10.1126/scitranslmed.aai8710.
8. Cao Z, Scandura JM, Inghirami GG, Shido K, Ding BS, Rafii S. Molecular Checkpoint Decisions Made by Subverted Vascular Niche Transform Indolent Tumor Cells into Chemoresistant Cancer Stem Cells. Cancer Cell. 2017 Jan 9;31(1):110-126. doi: 10.1016/j.ccell.2016.11.010.
9. Rafii S, Butler JM, Ding BS. Angiocrine functions of organ-specific endothelial cells. Nature. 2016 Jan 21;529(7586):316-25. doi: 10.1038/nature17040.
10. Cao Z, Lis R, Ginsberg M, Chavez D, Shido K, Rabbany SY, Fong GH, Sakmar TP, Rafii S, Ding BS. Targeting of the pulmonary capillary vascular niche promotes lung alveolar repair and ameliorates fibrosis. Nat Med. 2016 Feb;22(2):154-62. doi: 10.1038/nm.4035.
11. Rafii S, Cao Z, Lis R, Siempos II, Chavez D, Shido K, Rabbany SY, Ding BS. Platelet-derived SDF-1 primes the pulmonary capillary vascular niche to drive lung alveolar regeneration. Nat Cell Biol. 2015 Feb;17(2):123-136. doi: 10.1038/ncb3096.
12. Cao Z, Ding BS, Guo P, Lee SB, Butler JM, Casey SC, Simons M, Tam W, Felsher DW, Shido K, Rafii A, Scandura JM, Rafii S. Angiocrine factors deployed by tumor vascular niche induce B cell lymphoma invasiveness and chemoresistance. Cancer Cell. 2014 Mar 17;25(3):350-65. doi: 10.1016/j.ccr.2014.02.005